File:Fentanyl Synthesis p5.png
Original file (1,900 × 2,500 pixels, file size: 302 KB, MIME type: image/png)
| This is a file from the Wikimedia Commons. Information from its description page there is shown below. Commons is a freely licensed media file repository. You can help. |
Summary
| DescriptionFentanyl Synthesis p5.png |
English: The synthesis of fentanyl and its analogues are illustrated in this skeletal diagram. The modifications covered in this diagram have to do with stereochemistry and the assignment of unique Cahn-Ingold-Prelog R/S assignments to complex analogues of fentanyl.
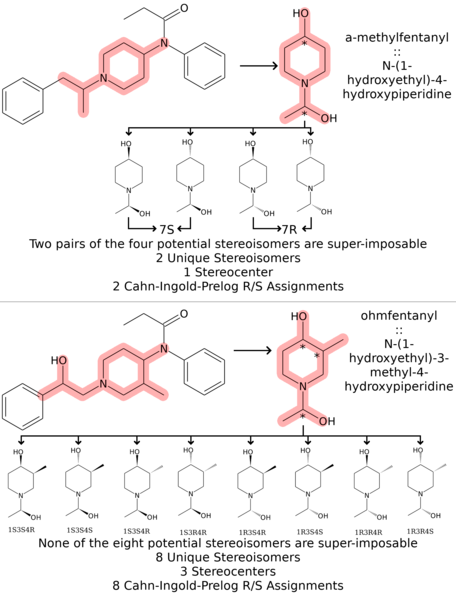
The stereochemistry of fentanyl analgoues can seem at first counter-intuitive, because of the complex and unique nature of the reasoning organic chemists must develop to internalize complex three dimensional geometries such as those needed to comprehend stereochemistry. Thankfully these images follow a simple procedure for organizing a potential analogue of fentanyl into the total number of unique stereoisomers, the number of true stereocenters on the molecule, and the number of Cahn-Ingold-Prelog R/S assignments that are appropriate for that analogue. The procedure used in the analysis of stereochemistry in these series of images is the following: 1. First the image is drawn out. 2. Second asterisks are placed by potential stereocenters as indicators (*). 3. Third the pairs of each stereocenters R and S orientations are combined through all possible permutations of stereocenters. 4. Fourth the permutations are checked for super-imposability, indicating that they are varying around what is not a true stereocenter and therefore the permutations are truly the self-same stereoisomer. This procedure will be used when making an assessment of the number of valid stereoisomers that an analogue of fentanyl will be predicted to have. Because the analogues of fentanyl are so large, and the moieities (sub-regions) of the molecule that are relevant to its chirality are so small, that we often reproduce the fentanyl analogue as a smaller, simpler molecule with the same number of, and dynamics between its, stereocenters. This saves significant space allowing us not to reproduce redundant material that consumes a lot of space on the image. The first case studied here is alpha-methylfentanyl. This group contains a substitution similar to the 3-methylfentanyl that was examined in the previous example on the previous image in this series (Fentanyl Synthesis p4.png), but it is on the phenethyl chain as apposed to being implanted on the piperidine ring. We then mark the two stereocenters, one on the C-4 carbon just as on fentanyl itself, and the other on the C-α (alpha carbon). To analogize these stereocenters we chose N-(1-hydroxyethyl)-4-hydroxypiperidine. When we draw out all potential stereoisomers, we see that the C-4 stereocenter is super-imposable, eliminating it as a true stereocenter. This leaves only 2 R/S assignments that follow the orientation of the stereocenter at the C-α (alpha carbon) position for the real α-methylfentanyl. These are labeled 7S and 7R, a reflection of the stereocenter in the piperidine derivative we used being at C-7 position. It is interesting that the C-4 stereocenter, which has no chiral activity in fentanyl (1st example), activiates it in 3-methylfentanyl with a on-the-ring addition, and loses it again in α-methylfentanyl with an off-the-ring addition. The second case studied here is ohmfentanyl. Ohmfentanyl has 3 potential stereocenters, which are best analogized by another piperidine derivative: N-(1-hydroxyethyl)-3-methyl-4-hydroxypiperidine. This uses a similar structure to analogize the three potential stereocenters in ohmfentanyl, namely the 4-C, the 3-C, and the β-C (beta carbon). These three stereocenters are analogized in the C-4, C-3, and C-7 respectively. When we draw all potential stereoisomers out we see that they are not super-imposable in any combination of pairing, and therefore we have 8 unique stereoisomers and 3 true stereocenters. This yields 8 unique R/S assignment combinations which are outlined as captions under the stereoisomers of the analogous molecule.Ελληνικά: Η σύνθεση της φεντανύλης και των αναλόγων της απεικονίζεται σε αυτό το σκελετικό διάγραμμα. Οι τροποποιήσεις που καλύπτονται σε αυτό το διάγραμμα έχουν να κάνουν με τη στερεοχημεία και την αντιστοίχιση μοναδικών αναθέσεων Cahn-Ingold-Prelog R/S σε σύνθετα ανάλογα της φεντανύλης.
Η στερεοχημεία των αναλγού της φεντανύλης μπορεί να φαίνεται στην αρχή αντίθετη, λόγω της πολύπλοκης και μοναδικής φύσης του συλλογισμού που οι οργανικοί χημικοί πρέπει να αναπτύξουν για να εσωτερικεύσουν πολύπλοκες τρισδιάστατες γεωμετρίες όπως αυτές που χρειάζονται για την κατανόηση της στερεοχημείας. Ευτυχώς, αυτές οι εικόνες ακολουθούν μια απλή διαδικασία για την οργάνωση ενός πιθανού αναλόγου της φαιντανύλης στον συνολικό αριθμό των μοναδικών στερεοϊσομερών, τον αριθμό των πραγματικών στερεοκεντρικών κέντρων στο μόριο και τον αριθμό των αναθέσεων Cahn-Ingold-Prelog R/S που είναι κατάλληλες για αυτό το ανάλογο . Η διαδικασία που χρησιμοποιείται στην ανάλυση της στερεοχημείας σε αυτές τις σειρές εικόνων είναι η εξής: 1. Πρώτα σχεδιάζεται η εικόνα. 2. Οι δεύτεροι αστερίσκοι τοποθετούνται από πιθανά στερεόκεντρα ως δείκτες (*). 3. Τρίτον, τα ζεύγη κάθε στερεοκεντρικού προσανατολισμού R και S συνδυάζονται μέσω όλων των πιθανών μεταθέσεων των στερεοκέντρων. 4. Τέταρτον, οι μεταθέσεις ελέγχονται για υπερ-αποκατάσταση, υποδεικνύοντας ότι ποικίλλουν γύρω από αυτό που δεν είναι πραγματικό στερεόκεντρο και επομένως οι μεταθέσεις είναι πραγματικά το ίδιο στερεοϊσομερές. Αυτή η διαδικασία θα χρησιμοποιηθεί κατά την αξιολόγηση του αριθμού των έγκυρων στερεοϊσομερών που προβλέπεται ότι θα έχει ένα ανάλογο της φαιντανύλης. Επειδή τα ανάλογα της φεντανύλης είναι τόσο μεγάλα και τα τμήματα (υποπεριοχές) του μορίου που σχετίζονται με τη χειρομορφία του είναι τόσο μικρά, που συχνά αναπαράγουμε το ανάλογο της φεντανύλης ως μικρότερο, απλούστερο μόριο με τον ίδιο αριθμό και δυναμική μεταξύ των στερεόκεντρων του. Αυτό εξοικονομεί σημαντικό χώρο επιτρέποντάς μας να μην αναπαράγουμε περιττό υλικό που καταναλώνει πολύ χώρο στην εικόνα. Η πρώτη περίπτωση που μελετήθηκε εδώ είναι η άλφα-μεθυλφεντανύλη. Αυτή η ομάδα περιέχει μια υποκατάσταση παρόμοια με την 3-μεθυλφεντανύλη που εξετάστηκε στο προηγούμενο παράδειγμα στην προηγούμενη εικόνα αυτής της σειράς (Fentanyl Synthesis p4.png), αλλά είναι στην αλυσίδα φαιναιθυλίου σε αντίθεση με την εμφύτευση στον δακτύλιο πιπεριδίνης. Στη συνέχεια σημειώνουμε τα δύο στερεόκεντρα, το ένα στον άνθρακα C-4 όπως ακριβώς στην ίδια τη φεντανύλη και το άλλο στο C-α (άνθρακας άλφα). Για να αναλογίσουμε αυτά τα στερεόκεντρα επιλέξαμε Ν-(1-υδροξυαιθυλ)-4-υδροξυπιπεριδίνη. Όταν σχεδιάζουμε όλα τα πιθανά στερεοϊσομερή, βλέπουμε ότι το στερεόκεντρο C-4 είναι υπερ-αδύνατο, εξαλείφοντάς το ως πραγματικό στερεόκεντρο. Αυτό αφήνει μόνο 2 αναθέσεις R/S που ακολουθούν τον προσανατολισμό του στερεοκεντρικού στη θέση C-α (άλφα άνθρακας) για την πραγματική α-μεθυλφεντανύλη. Αυτά φέρουν τις ετικέτες 7S και 7R, μια αντανάκλαση του στερεοκεντρικού στο παράγωγο πιπεριδίνης που χρησιμοποιήσαμε ότι βρίσκεται στη θέση C-7. Είναι ενδιαφέρον ότι το στερεόκεντρο C-4, το οποίο δεν έχει χειρόμορφη δράση στη φεντανύλη (1ο παράδειγμα), την ενεργοποιεί σε 3-μεθυλφεντανύλη με μια προσθήκη στο δακτύλιο και τη χάνει ξανά σε α-μεθυλφεντανύλη με μια εκτός - προσθήκη δακτυλίου. Η δεύτερη περίπτωση που μελετάται εδώ είναι η ωμφεντανύλη. Το Ohmfentanyl έχει 3 πιθανά στερεόκεντρα, τα οποία αναλογίζονται καλύτερα με ένα άλλο παράγωγο πιπεριδίνης: Ν-(1-υδροξυαιθυλ)-3-μεθυλ-4-υδροξυπιπεριδίνη. Αυτό χρησιμοποιεί μια παρόμοια δομή για να αναλογίσει τα τρία πιθανά στερεοκέντρα στην ωμφεντανύλη, δηλαδή το 4-C, το 3-C και το β-C (βήτα άνθρακας). Αυτά τα τρία στερεόκεντρα αναλογίζονται στα C-4, C-3 και C-7 αντίστοιχα. Όταν βγάζουμε όλα τα πιθανά στερεοϊσομερή, βλέπουμε ότι δεν είναι υπερ-επιβλητέα σε κανένα συνδυασμό ζευγαρώματος, και επομένως έχουμε 8 μοναδικά στερεοϊσομερή και 3 αληθινά στερεόκεντρα. Αυτό αποδίδει 8 μοναδικούς συνδυασμούς εκχώρησης R/S που περιγράφονται ως λεζάντες κάτω από τα στερεοϊσομερή του ανάλογου μορίου.Latina: Synthesis fentanylis et ejus analoga in hoc schemate sceleti illustrantur. Modificationes in hoc diagrammate obductae cum stereochemistica et assignatione singularum Cahn-Ingold-Prelog R/S assignationes analogorum fentanylorum implicatae sunt.
Stereochemistria fentanyl analgouarum primo intuitiva videri potest, propter complexam et unicam rationem chemicorum organici ratiocinandi oportet ut tres geometrias dimensionales complexas interneant, quales sunt quae ad stereochemiam comprehendendam requiruntur. Grato hae imagines sequuntur modum simplicem ad analogum potentiae fentanylicae ordinandum in totum numerum unicorum stereoisoriorum, numerum verorum stereocentorum in moleculo, et numerus assignationum Cahn-Ingold-Prelog R/S quae analogo aptae sunt. . Ratio in analysi stereochemisticae in his imaginum serie adhibita est haec: 1. Primum imago educitur. 2. Asterisci secundi ponuntur a stereocentris potentialibus ut indicibus (*). 3. Tertium paria singulorum stereocentorum R et S orientationes coniunguntur per omnes permutationes stereocentorum possibilium. 4. Quarta permutationes restringuntur pro superimpossibilitate, significans se variare circa non verum stereocenter et ideo permutationes vere idem stereoiso- res sunt. Haec ratio adhibebitur cum aestimationem numeri stereoiso- riorum validorum faciendorum analogum fentanyl habere praedictum erit. Quia analoga fentanyli tam magnae sunt, & medietates moleculi, quae ad chiralitatem ejus pertinent, tam parvae funt, ut identidem fentanylum referamus analogum cum minori, & simpliciori moleculo cum totidem, & motus inter suos, stereocentres. Hoc spatium significantem servat sinit nos non effingere materiam redundantem quae multum spatii in imagine consumit. Primus casus hic studuit alpha methylfentanyl. Circulus hic habet substitutionem similem methylfentanyl 3-methylfentanyi quae in priori exemplo de imagine priore in hac serie explorata est (Fentanyl Synthesis p4.png), sed est in phenethyl catenae sicut apposita anuli piperidini inserta. Deinde duos stereocentas notamus, unum in carbone C-4 sicut in ipsa fentanyl, alterum in C-α (alpha carbonis). Ad analogiam horum stereocentorum elegimus N-(1-hydroxyethyl) -4-hydroxypiperidinem. Cum omnes stereoisomos potentiales educimus, videmus C-4 stereocenter super-impossibile esse, ut vero stereocenter eliminando. Haec folia tantum 2 R/S assignationes quae orientationem stereocenter in C-α (alpha carbonis) positionis realis α-methylfentany sequuntur. Hi intitulati sunt 7S et 7R, repercussio stereocenter in piperidine derivativi in C-7 positione adhibita. Iucundum est quod C-4 stereocenter, quod nullam habet actionem chiralis in fentanyl (1st exemplo), operatur in 3-methylfentany cum additione anuli, eamque iterum amittit in α-methylfentanyl cum extemporalitate. -ring praeter. Secundus casus hie studuit ohmfentanyl. Ohmfentanyl habet 3 potentiales stereocentas, quae maxime ab alio derivativo piperidine analogatae sunt: N-(1-hydroxyethyl) 3-methyl-4-hydroxypiperidinem. Simili structura haec utitur ad analogiam trium potentialium stereocentorum in ohmfentanyl, nempe 4-C, 3-C, et aba-C (beta carbonis). Haec tria stereocentra in C-4, C-3 et C-7 respective analoga sunt. Cum omnes stereoisomos potentias extrahuntur, videmus eas non esse super-imposabiles in omni copulatione coniugationis, et ideo octo stereoisomosores singulares et 3 veros stereocentres habemus. Hoc dat 8 singulares R/S junctiones assignationis quae sicut captiones sub stereoisomers moleculi analogi delineatur.Italiano: La sintesi del fentanil e dei suoi analoghi sono illustrati in questo diagramma scheletrico. Le modifiche trattate in questo diagramma hanno a che fare con la stereochimica e l'assegnazione di assegnazioni uniche di Cahn-Ingold-Prelog R/S ad analoghi complessi del fentanil.
La stereochimica degli analgesici di fentanil può sembrare a prima vista contro-intuitiva, a causa della natura complessa e unica del ragionamento che i chimici organici devono sviluppare per interiorizzare geometrie tridimensionali complesse come quelle necessarie per comprendere la stereochimica. Per fortuna queste immagini seguono una semplice procedura per organizzare un potenziale analogo del fentanil nel numero totale di stereoisomeri unici, il numero di veri stereocentri sulla molecola e il numero di assegnazioni Cahn-Ingold-Prelog R/S che sono appropriate per quell'analogo . La procedura utilizzata nell'analisi della stereochimica in queste serie di immagini è la seguente: 1. Per prima cosa viene disegnata l'immagine. 2. I secondi asterischi sono posti da potenziali stereocentri come indicatori (*). 3. In terzo luogo, le coppie di orientamenti R e S di ogni stereocentro sono combinate attraverso tutte le possibili permutazioni di stereocentri. 4. In quarto luogo, le permutazioni sono verificate per la sovrapponibilità, indicando che variano attorno a ciò che non è un vero stereocentro e quindi le permutazioni sono veramente lo stesso stereoisomero. Questa procedura verrà utilizzata per valutare il numero di stereoisomeri validi che si prevede avrà un analogo del fentanil. Poiché gli analoghi del fentanil sono così grandi e le frazioni (sottoregioni) della molecola che sono rilevanti per la sua chiralità sono così piccole, che spesso riproduciamo l'analogo del fentanil come una molecola più piccola e più semplice con lo stesso numero di, e dinamica tra i suoi, stereocentri. Ciò consente di risparmiare spazio significativo consentendoci di non riprodurre materiale ridondante che consuma molto spazio sull'immagine. Il primo caso qui studiato è l'alfa-metilfentanil. Questo gruppo contiene una sostituzione simile al 3-metilfentanil che è stato esaminato nell'esempio precedente sull'immagine precedente di questa serie (Fentanyl Synthesis p4.png), ma è sulla catena fenetile come opposto ad essere impiantato sull'anello piperidinico. Segnaliamo quindi i due stereocentri, uno sul carbonio C-4 proprio come sul fentanil stesso, e l'altro sul C-α (carbonio alfa). Per analogizzare questi stereocentri abbiamo scelto la N-(1-idrossietil)-4-idrossipiperidina. Quando estraiamo tutti i potenziali stereoisomeri, vediamo che lo stereocentro C-4 è sovrapponibile, eliminandolo come un vero stereocentro. Questo lascia solo 2 incarichi R/S che seguono l'orientamento dello stereocentro nella posizione C-α (carbonio alfa) per il vero α-metilfentanil. Questi sono etichettati 7S e 7R, un riflesso dello stereocentro nel derivato piperidinico che abbiamo usato essendo in posizione C-7. È interessante notare che lo stereocentro C-4, che non ha attività chirale nel fentanil (1° esempio), lo attivi in 3-metilfentanil con un'aggiunta sull'anello e lo perda nuovamente in α-metilfentanil con un -aggiunta dell'anello. Il secondo caso qui studiato è l'ohmfentanil. Ohmfentanil ha 3 potenziali stereocentri, che sono meglio analoghi a un altro derivato della piperidina: N-(1-idrossietil)-3-metil-4-idrossipiperidina. Questo utilizza una struttura simile per analogiare i tre potenziali stereocentri in ohmfentanil, vale a dire il 4-C, il 3-C e il β-C (beta carbonio). Questi tre stereocentri sono analogici rispettivamente in C-4, C-3 e C-7. Quando estraiamo tutti i potenziali stereoisomeri, vediamo che non sono sovrapponibili in nessuna combinazione di accoppiamento, e quindi abbiamo 8 stereoisomeri unici e 3 veri stereocentri. Ciò produce 8 combinazioni di assegnazione R/S uniche che sono descritte come didascalie sotto gli stereoisomeri della molecola analoga.Español: La síntesis de fentanilo y sus análogos se ilustran en este diagrama esquelético. Las modificaciones cubiertas en este diagrama tienen que ver con la estereoquímica y la asignación de asignaciones únicas de Cahn-Ingold-Prelog R/S a análogos complejos de fentanilo.
La estereoquímica de los análogos de fentanilo puede parecer al principio contraria a la intuición, debido a la naturaleza compleja y única del razonamiento que los químicos orgánicos deben desarrollar para internalizar geometrías tridimensionales complejas como las necesarias para comprender la estereoquímica. Afortunadamente, estas imágenes siguen un procedimiento simple para organizar un análogo potencial del fentanilo en la cantidad total de estereoisómeros únicos, la cantidad de estereocentros verdaderos en la molécula y la cantidad de asignaciones Cahn-Ingold-Prelog R/S que son apropiadas para ese análogo. . El procedimiento utilizado en el análisis de la estereoquímica en esta serie de imágenes es el siguiente: 1. Primero se dibuja la imagen. 2. Los segundos asteriscos son colocados por estereocentros potenciales como indicadores (*). 3. Tercero, los pares de cada uno de los estereocentros R y S se combinan a través de todas las posibles permutaciones de estereocentros. 4. En cuarto lugar, se comprueba la superimposibilidad de las permutaciones, lo que indica que varían en torno a lo que no es un estereocentro verdadero y, por lo tanto, las permutaciones son realmente el mismo estereoisómero. Este procedimiento se utilizará al realizar una evaluación del número de estereoisómeros válidos que se prevea que tendrá un análogo del fentanilo. Debido a que los análogos del fentanilo son tan grandes y los restos (subregiones) de la molécula que son relevantes para su quiralidad son tan pequeños, a menudo reproducimos el análogo del fentanilo como una molécula más pequeña y simple con el mismo número y dinámica entre sus, estereocentros. Esto ahorra un espacio significativo que nos permite no reproducir material redundante que consume mucho espacio en la imagen. El primer caso estudiado aquí es el alfa-metilfentanilo. Este grupo contiene una sustitución similar al 3-metilfentanilo que se examinó en el ejemplo anterior de la imagen anterior de esta serie (Fentanyl Synthesis p4.png), pero está en la cadena de fenetilo en lugar de estar implantado en el anillo de piperidina. Luego marcamos los dos estereocentros, uno en el carbono C-4 al igual que en el propio fentanilo, y el otro en el C-α (carbono alfa). Para comparar estos estereocentros, elegimos N-(1-hidroxietil)-4-hidroxipiperidina. Cuando extraemos todos los estereoisómeros potenciales, vemos que el estereocentro C-4 es superponible, eliminándolo como un verdadero estereocentro. Esto deja solo 2 asignaciones R/S que siguen la orientación del estereocentro en la posición C-α (carbono alfa) para el α-metilfentanilo real. Estos están etiquetados como 7S y 7R, un reflejo del estereocentro en el derivado de piperidina que usamos en la posición C-7. Es interesante que el estereocentro C-4, que no tiene actividad quiral en fentanilo (primer ejemplo), lo activa en 3-metilfentanilo con una adición en el anillo y lo vuelve a perder en α-metilfentanilo con una adición fuera del anillo. -adición de anillo. El segundo caso estudiado aquí es el ohmfentanilo. El ohmfentanilo tiene 3 estereocentros potenciales, que se comparan mejor con otro derivado de piperidina: N-(1-hidroxietil)-3-metil-4-hidroxipiperidina. Esto utiliza una estructura similar para hacer una analogía de los tres estereocentros potenciales en el ohmfentanilo, a saber, el 4-C, el 3-C y el β-C (carbono beta). Estos tres estereocentros se analogizan en C-4, C-3 y C-7 respectivamente. Cuando extraemos todos los estereoisómeros potenciales, vemos que no son superponibles en ninguna combinación de emparejamiento y, por lo tanto, tenemos 8 estereoisómeros únicos y 3 estereocentros verdaderos. Esto produce 8 combinaciones únicas de asignación de R/S que se describen como leyendas bajo los estereoisómeros de la molécula análoga.Français : La synthèse du fentanyl et de ses analogues est illustrée dans ce diagramme squelettique. Les modifications couvertes dans ce diagramme concernent la stéréochimie et l'attribution d'attributions R/S uniques de Cahn-Ingold-Prelog à des analogues complexes du fentanyl.
La stéréochimie des analgoues de fentanyl peut sembler à première vue contre-intuitive, en raison de la nature complexe et unique du raisonnement que les chimistes organiques doivent développer pour intérioriser des géométries tridimensionnelles complexes telles que celles nécessaires pour comprendre la stéréochimie. Heureusement, ces images suivent une procédure simple pour organiser un analogue potentiel du fentanyl en nombre total de stéréoisomères uniques, en nombre de vrais stéréocentres sur la molécule et en nombre d'attributions Cahn-Ingold-Prelog R/S appropriées pour cet analogue. . La procédure utilisée dans l'analyse de la stéréochimie dans ces séries d'images est la suivante : 1. L'image est d'abord dessinée. 2. Les deuxièmes astérisques sont placés par les stéréocentres potentiels comme indicateurs (*). 3. Troisièmement, les paires d'orientations R et S de chaque stéréocentre sont combinées à travers toutes les permutations possibles de stéréocentres. 4. Quatrièmement, les permutations sont vérifiées pour la super-impossibilité, indiquant qu'elles varient autour de ce qui n'est pas un vrai stéréocentre et que, par conséquent, les permutations sont vraiment le même stéréoisomère. Cette procédure sera utilisée lors de l'évaluation du nombre de stéréoisomères valides qu'un analogue du fentanyl sera censé avoir. Parce que les analogues du fentanyl sont si gros et que les fractions (sous-régions) de la molécule qui sont pertinentes pour sa chiralité sont si petites, que nous reproduisons souvent l'analogue du fentanyl sous la forme d'une molécule plus petite et plus simple avec le même nombre de, et dynamique entre ses stéréocentres. Cela permet un gain de place important nous permettant de ne pas reproduire de matériel redondant qui consomme beaucoup d'espace sur l'image. Le premier cas étudié ici est l'alpha-méthylfentanyl. Ce groupe contient une substitution similaire au 3-méthylfentanyl qui a été examiné dans l'exemple précédent sur l'image précédente de cette série (Fentanyl Synthesis p4.png), mais il se trouve sur la chaîne phénéthyle par opposition à l'implantation sur le cycle pipéridine. On marque ensuite les deux stéréocentres, l'un sur le carbone C-4 comme sur le fentanyl lui-même, et l'autre sur le C-α (carbone alpha). Pour analogiser ces stéréocentres, nous avons choisi la N-(1-hydroxyéthyl)-4-hydroxypipéridine. Lorsque nous extrayons tous les stéréoisomères potentiels, nous voyons que le stéréocentre C-4 est super-imposable, l'éliminant en tant que véritable stéréocentre. Cela ne laisse que 2 affectations R/S qui suivent l'orientation du stéréocentre à la position C-α (carbone alpha) pour le vrai α-méthylfentanyl. Ceux-ci sont étiquetés 7S et 7R, un reflet du stéréocentre dans le dérivé de pipéridine que nous avons utilisé étant en position C-7. Il est intéressant de noter que le stéréocentre C-4, qui n'a pas d'activité chirale dans le fentanyl (1er exemple), l'active dans le 3-méthylfentanyl avec une addition sur le cycle, et le perd à nouveau dans l'α-méthylfentanyl avec une addition hors du cycle. -ajout d'anneaux. Le deuxième cas étudié ici est l'ohmfentanyl. Ohmfentanyl a 3 stéréocentres potentiels, qui sont mieux analogues à un autre dérivé de la pipéridine : la N-(1-hydroxyéthyl)-3-méthyl-4-hydroxypipéridine. Cela utilise une structure similaire pour analogiser les trois stéréocentres potentiels de l'ohmfentanyl, à savoir le 4-C, le 3-C et le β-C (bêta carbone). Ces trois stéréocentres sont respectivement analogues aux C-4, C-3 et C-7. Lorsque nous extrayons tous les stéréoisomères potentiels, nous voyons qu'ils ne sont superposables dans aucune combinaison d'appariement, et nous avons donc 8 stéréoisomères uniques et 3 vrais stéréocentres. Cela donne 8 combinaisons d'attribution R/S uniques qui sont décrites sous forme de légendes sous les stéréoisomères de la molécule analogue.Deutsch: Die Synthese von Fentanyl und seinen Analoga ist in diesem Skelettdiagramm dargestellt. Die in diesem Diagramm behandelten Modifikationen haben mit der Stereochemie und der Zuordnung eindeutiger Cahn-Ingold-Prelog-R/S-Zuordnungen zu komplexen Analoga von Fentanyl zu tun.
Die Stereochemie von Fentanyl-Analoga kann zunächst kontraintuitiv erscheinen, da organische Chemiker aufgrund der komplexen und einzigartigen Art der Argumentation entwickeln müssen, um komplexe dreidimensionale Geometrien zu verinnerlichen, wie sie zum Verständnis der Stereochemie erforderlich sind. Glücklicherweise folgen diese Bilder einem einfachen Verfahren zum Organisieren eines potenziellen Analogons von Fentanyl in die Gesamtzahl einzigartiger Stereoisomere, die Anzahl echter Stereozentren im Molekül und die Anzahl der Cahn-Ingold-Prelog-R/S-Zuordnungen, die für dieses Analogon geeignet sind . Das bei der Analyse der Stereochemie in diesen Bildserien verwendete Verfahren ist das folgende: 1. Zuerst wird das Bild gezeichnet. 2. Zweite Sternchen werden von potentiellen Stereozentren als Indikatoren (*) platziert. 3. Drittens werden die Paare der R- und S-Orientierungen jedes Stereozentrums durch alle möglichen Permutationen von Stereozentren kombiniert. 4. Viertens werden die Permutationen auf Überlagerung geprüft, was darauf hinweist, dass sie um etwas herum variieren, das kein echtes Stereozentrum ist, und daher die Permutationen wirklich das gleiche Stereoisomer sind. Dieses Verfahren wird verwendet, um die Anzahl gültiger Stereoisomere zu bestimmen, die ein Analogon von Fentanyl voraussichtlich aufweisen wird. Weil die Analoga von Fentanyl so groß und die für seine Chiralität relevanten Einheiten (Unterregionen) des Moleküls so klein sind, dass wir das Fentanyl-Analogon oft als kleineres, einfacheres Molekül mit der gleichen Anzahl von reproduzieren Dynamik zwischen seinen Stereozentren. Dies spart erheblich Platz, sodass wir kein überflüssiges Material reproduzieren müssen, das viel Platz auf dem Bild beansprucht. Der erste hier untersuchte Fall ist Alpha-Methylfentanyl. Diese Gruppe enthält eine Substitution ähnlich dem 3-Methylfentanyl, das im vorherigen Beispiel auf dem vorherigen Bild in dieser Serie (Fentanyl-Synthese p4.png) untersucht wurde, aber es befindet sich auf der Phenethylkette und nicht auf dem Piperidinring. Wir markieren dann die beiden Stereozentren, eines am C-4-Kohlenstoff, genau wie bei Fentanyl selbst, und das andere am C-α (Alpha-Kohlenstoff). Um diese Stereozentren zu analogisieren, wählten wir N-(1-Hydroxyethyl)-4-hydroxypiperidin. Wenn wir alle potenziellen Stereoisomere herausziehen, sehen wir, dass das C-4-Stereozentrum überlagerbar ist, wodurch es als echtes Stereozentrum eliminiert wird. Dies lässt nur 2 R/S-Zuordnungen übrig, die der Orientierung des Stereozentrums an der Position C-α (Alpha-Kohlenstoff) für das echte α-Methylfentanyl folgen. Diese sind mit 7S und 7R bezeichnet, was das Stereozentrum in dem von uns verwendeten Piperidinderivat widerspiegelt, das sich an der C-7-Position befindet. Interessant ist, dass das C-4-Stereozentrum, das bei Fentanyl (1. Beispiel) keine chirale Aktivität besitzt, es bei 3-Methylfentanyl bei einer On-the-Ring-Addition aktiviert und bei α-Methylfentanyl bei Off-the wieder verliert -Ring hinaus. Der zweite hier untersuchte Fall ist Ohmfentanyl. Ohmfentanyl hat 3 potenzielle Stereozentren, die am besten durch ein anderes Piperidinderivat analogisiert werden: N-(1-Hydroxyethyl)-3-methyl-4-hydroxypiperidin. Dieses verwendet eine ähnliche Struktur, um die drei potenziellen Stereozentren in Ohmfentanyl zu analogisieren, nämlich das 4-C, das 3-C und das β-C (beta-Kohlenstoff). Diese drei Stereozentren sind in C-4, C-3 bzw. C-7 analogisiert. Wenn wir alle potenziellen Stereoisomere herausziehen, sehen wir, dass sie in keiner Paarungskombination überlagert werden können, und daher haben wir 8 einzigartige Stereoisomere und 3 echte Stereozentren. Dies ergibt 8 einzigartige R/S-Zuordnungskombinationen, die als Beschriftungen unter den Stereoisomeren des analogen Moleküls aufgeführt sind.العربية: تم توضيح تركيب الفنتانيل ونظائره في هذا الرسم التخطيطي للهيكل العظمي. تتعلق التعديلات الواردة في هذا الرسم البياني بالكيمياء الفراغية وتخصيص تعيينات Cahn-Ingold-Prelog R / S الفريدة لنظائر الفنتانيل المعقدة.
يمكن أن تبدو الكيمياء الفراغية لنظائر الفنتانيل غير بديهية للوهلة الأولى ، بسبب الطبيعة المعقدة والفريدة للمنطق الذي يجب على الكيميائيين العضويين تطويره لاستيعاب الأشكال الهندسية المعقدة ثلاثية الأبعاد مثل تلك اللازمة لفهم الكيمياء الفراغية. لحسن الحظ ، تتبع هذه الصور إجراءً بسيطًا لتنظيم تناظري محتمل للفنتانيل في العدد الإجمالي للأيزومرات الفراغية الفريدة ، وعدد أجهزة التوسط الفراغي الحقيقية على الجزيء ، وعدد تخصيصات Cahn-Ingold-Prelog R / S المناسبة لذلك التناظرية. . الإجراء المستخدم في تحليل الكيمياء الفراغية في هذه السلسلة من الصور هو كالتالي: 1. أولاً يتم رسم الصورة. 2. يتم وضع العلامات النجمية الثانية بواسطة أجهزة مركزية مجسمة محتملة كمؤشرات (*). 3. ثالثًا ، يتم دمج أزواج كل من مكبرات الصوت الفراغية R و S من خلال جميع التباديل الممكنة للمركزات الفراغية. 4. رابعًا ، يتم فحص التباديل من أجل الاستحالة الفائقة ، مما يشير إلى أنها تختلف حول ما هو ليس مركزًا فراغيًا حقيقيًا ، وبالتالي فإن التباديل هي في الحقيقة نفس الأيزومر الفراغي. سيتم استخدام هذا الإجراء عند إجراء تقييم لعدد الأيزومرات الفراغية الصالحة التي يتوقع أن يمتلكها نظير الفنتانيل. نظرًا لأن نظائر الفنتانيل كبيرة جدًا ، كما أن الأجزاء الصغيرة (المناطق الفرعية) للجزيء ذات الصلة بتزاوجها صغيرة جدًا ، لدرجة أننا غالبًا ما نعيد إنتاج نظير الفنتانيل كجزيء أصغر وأبسط بنفس العدد من و ديناميات بين أجهزة مركزية الفراغ. هذا يوفر مساحة كبيرة مما يسمح لنا بعدم إعادة إنتاج المواد الزائدة التي تستهلك مساحة كبيرة على الصورة. الحالة الأولى التي تمت دراستها هنا هي alpha-methylfentanyl. تحتوي هذه المجموعة على بديل مشابه لـ 3-methylfentanyl الذي تم فحصه في المثال السابق على الصورة السابقة في هذه السلسلة (Fentanyl Synthesis p4.png) ، ولكنه موجود على سلسلة phenethyl كما هو مناسب للزرع على حلقة البيبيريدين. ثم نضع علامة على مركبين ، أحدهما على كربون C-4 تمامًا كما هو الحال في الفنتانيل نفسه ، والآخر على C-α (كربون ألفا). لتمثيل هذه المجسمات اخترنا N- (1-hydroxyethyl) -4-hydroxypiperidine. عندما نستخرج جميع الأيزومرات الفراغية المحتملة ، نرى أن جهاز C-4 المجسم مستحيل للغاية ، مما يلغيه كمركز مجسم حقيقي. هذا يترك فقط تخصيصين R / S يتبعان اتجاه المجسم في موضع C-α (كربون ألفا) لـ α-methylfentanyl الحقيقي. هذه المسمى 7S و 7R ، انعكاس للمركز المجسم في مشتق البيبيريدين الذي استخدمناه في وضع C-7. من المثير للاهتمام أن المركز المجسم C-4 ، الذي لا يحتوي على نشاط مراوان في الفنتانيل (المثال الأول) ، ينشطه في 3 ميثيل فينتانيل مع إضافة على الحلقة ، ويفقده مرة أخرى في α-methylfentanyl مع إضافة الخيط. الحالة الثانية التي تمت دراستها هنا هي أومفنتانيل. يحتوي Ohmfentanyl على 3 أجهزة ستيموسينتير محتملة ، والتي يتم تشبيهها بشكل أفضل بمشتق آخر من البيبيريدين: N- (1-hydroxyethyl) -3-methyl-4-hydroxypiperidine. يستخدم هذا هيكلًا مشابهًا لتمثيل ثلاثة مكبرات صوت محتملة في أومفنتانيل ، وهي 4-C ، و 3-C ، و β-C (كربون بيتا). يتم تناظرية هذه المجسمات الثلاثة في C-4 و C-3 و C-7 على التوالي. عندما نخرج جميع الأيزومرات الفراغية المحتملة ، نرى أنها ليست مستحيلة للغاية في أي مزيج من الاقتران ، وبالتالي لدينا 8 متطباتات استريو مجسمة فريدة و 3 مجسمات حقيقية. ينتج عن هذا 8 مجموعات تخصيص R / S فريدة تم تحديدها كتعليقات توضيحية تحت الأيزومرات الفراغية للجزيء المماثل.فارسی: سنتز فنتانیل و آنالوگ های آن در این نمودار اسکلتی نشان داده شده است. تغییرات پوشش داده شده در این نمودار مربوط به استریوشیمی و انتساب تخصیص منحصر به فرد Cahn-Ingold-Prelog R/S به آنالوگ های پیچیده فنتانیل است.
استریوشیمی آنالگوهای فنتانیل در ابتدا می تواند غیر شهودی به نظر برسد، زیرا به دلیل ماهیت پیچیده و منحصر به فرد استدلال، شیمیدانان آلی باید برای درونی کردن هندسه های سه بعدی پیچیده مانند موارد مورد نیاز برای درک استریوشیمی توسعه دهند. خوشبختانه این تصاویر از یک روش ساده برای سازماندهی آنالوگ بالقوه فنتانیل به تعداد کل استریو ایزومرهای منحصر به فرد، تعداد استریوسنترهای واقعی روی مولکول و تعداد تخصیص R/S Cahn-Ingold-Prelog که برای آن آنالوگ مناسب است پیروی می کنند. . روش مورد استفاده در تجزیه و تحلیل استریوشیمی در این سری از تصاویر به شرح زیر است: 1. ابتدا تصویر کشیده می شود. 2. ستاره دوم توسط stereocenters بالقوه به عنوان نشانگر (*) قرار می گیرد. 3. ثالثاً جفتهای جهتگیری R و S هر یک از مراکز کلیشهای از طریق همه جایگشتهای ممکن استریوسنتز ترکیب میشوند. 4. چهارم، جایگشتها از نظر غیرقابلممکن بودن بررسی میشوند، که نشان میدهد در اطراف چیزی که یک مرکز کلیشه واقعی نیست تغییر میکنند و بنابراین جایگشتها واقعاً همان استریوایزومر خود هستند. این روش هنگام ارزیابی تعداد استریو ایزومرهای معتبری که پیش بینی می شود آنالوگ فنتانیل داشته باشد، استفاده می شود. از آنجایی که آنالوگ های فنتانیل بسیار بزرگ هستند و قسمت های (زیر مناطق) مولکول که به کایرالیته آن مربوط می شوند بسیار کوچک هستند، به طوری که ما اغلب آنالوگ فنتانیل را به عنوان یک مولکول کوچکتر و ساده تر با همان تعداد، و پویایی بین stereocenters آن. این باعث صرفه جویی در فضای قابل توجهی می شود و به ما امکان می دهد مواد اضافی را که فضای زیادی را روی تصویر مصرف می کنند، بازتولید نکنیم. اولین مورد مورد مطالعه در اینجا آلفا متیل فنتانیل است. این گروه حاوی جایگزینی مشابه 3-متیل فنتانیل است که در مثال قبلی در تصویر قبلی این سری بررسی شد (Fentanyl Synthesis p4.png)، اما بر روی زنجیره فنتیل قرار دارد که بر روی حلقه پیپریدین کاشته شده است. سپس دو استریوسنتز را علامت گذاری می کنیم، یکی روی کربن C-4 درست مانند خود فنتانیل، و دیگری روی C-α (کربن آلفا). برای آنالوگ کردن این stereocenters ما N-(1-hydroxyethyl)-4-hydroxypiperidine را انتخاب کردیم. وقتی همه استریو ایزومرهای بالقوه را بیرون می آوریم، می بینیم که استریوستر C-4 فوق العاده غیرممکن است و آن را به عنوان یک استریوسنت واقعی حذف می کند. این تنها 2 تخصیص R/S باقی میگذارد که جهتگیری کانون در موقعیت C-α (کربن آلفا) را برای α-متیل فنتانیل واقعی دنبال میکنند. اینها با برچسب 7S و 7R، بازتابی از مرکز فضایی در مشتق پیپریدین که ما در موقعیت C-7 استفاده کردیم، هستند. جالب است که stereocenter C-4 که هیچ فعالیت کایرالی در فنتانیل ندارد (مثال اول)، آن را در 3-methylfentanyl با افزودن روی حلقه فعال می کند و دوباره آن را در α-methylfentanyl با یک off-the از دست می دهد. -افزودن حلقه مورد دوم مورد مطالعه در اینجا Ohmfentanyl است. Ohmfentanyl دارای 3 استریوستر بالقوه است که به بهترین وجه توسط یک مشتق دیگر پیپریدین آنالوگ می شوند: N-(1-hydroxyethyl)-3-methyl-4-hydroxypiperidine. این از یک ساختار مشابه برای آنالوگ کردن سه استریوستر بالقوه در اهمفنتانیل، یعنی 4-C، 3-C، و β-C (کربن بتا) استفاده می کند. این سه stereocenter به ترتیب در C-4، C-3 و C-7 مشابه هستند. وقتی همه استریو ایزومرهای بالقوه را بیرون میکشیم، میبینیم که آنها در هیچ ترکیبی از جفتسازی غیرقابل تحمیل نیستند، و بنابراین ما 8 استریو ایزومر منحصر به فرد و 3 استریوستر واقعی داریم. این 8 ترکیب اختصاصی R/S منحصر به فرد را به دست می دهد که به عنوان زیرنویس زیر استریو ایزومرهای مولکول مشابه مشخص شده اند.اردو: فینٹینیل کی ترکیب اور اس کے ینالاگوں کو اس سکیلیٹل ڈایاگرام میں دکھایا گیا ہے۔ اس خاکہ میں شامل ترمیمات کا تعلق سٹیریو کیمسٹری اور فینٹینیل کے پیچیدہ اینالاگوں کے لیے منفرد Cahn-Ingold-Prelog R/S اسائنمنٹس کے ساتھ ہے۔
فینٹینیل اینالگوز کی سٹیریو کیمسٹری پہلے تو متضاد معلوم ہو سکتی ہے، کیونکہ استدلال کی پیچیدہ اور منفرد نوعیت کی وجہ سے نامیاتی کیمیا دانوں کو پیچیدہ تین جہتی جیومیٹریوں کو اندرونی بنانے کے لیے تیار کرنا چاہیے جیسا کہ سٹیریو کیمسٹری کو سمجھنے کے لیے درکار ہے۔ شکر ہے کہ یہ تصاویر فینٹینیل کے ممکنہ اینالاگ کو منفرد سٹیریوائزومرز کی کل تعداد، مالیکیول پر حقیقی سٹیریو سینٹرز کی تعداد، اور Cahn-Ingold-Prelog R/S اسائنمنٹس کی تعداد میں ترتیب دینے کے لیے ایک سادہ طریقہ کار کی پیروی کرتی ہیں جو اس اینالاگ کے لیے موزوں ہیں۔ . تصویروں کی ان سیریز میں سٹیریو کیمسٹری کے تجزیہ میں استعمال ہونے والا طریقہ کار درج ذیل ہے: 1. پہلے تصویر کھینچی گئی ہے۔ 2. دوسرا ستارہ ممکنہ سٹیریو سینٹرز کے ذریعہ اشارے (*) کے طور پر رکھا جاتا ہے۔ 3. تیسرا ہر سٹیریو سینٹرز R اور S اورینٹیشنز کے جوڑے سٹیریو سینٹرز کے تمام ممکنہ ترتیب کے ذریعے یکجا کیے جاتے ہیں۔ 4. چوتھے پرمیوٹیشنز کو انتہائی ناممکنیت کے لیے چیک کیا جاتا ہے، جس سے یہ ظاہر ہوتا ہے کہ وہ اس کے ارد گرد مختلف ہو رہے ہیں جو ایک حقیقی سٹیریو سینٹر نہیں ہے اور اس وجہ سے پرمیوٹیشنز واقعی خود ایک ہی سٹیریوائزومر ہیں۔ یہ طریقہ کار اس وقت استعمال کیا جائے گا جب درست سٹیریوائزمرز کی تعداد کا اندازہ لگایا جائے گا جس کی فینٹینیل کے ینالاگ کی پیش گوئی کی جائے گی۔ کیونکہ فینٹینیل کے ینالاگ اتنے بڑے ہیں، اور مالیکیول کے موئیئٹیز (ذیلی خطوں) جو کہ اس کے کیرالیٹی سے متعلق ہیں، اتنے چھوٹے ہیں، کہ ہم اکثر فینٹینیل اینالاگ کو ایک چھوٹے، آسان مالیکیول کے طور پر دوبارہ پیش کرتے ہیں جس کی تعداد اتنی ہی ہے، اور اس کے، سٹیریو سینٹرز کے درمیان حرکیات۔ اس سے اہم جگہ کی بچت ہوتی ہے جس سے ہمیں بے کار مواد کو دوبارہ پیدا کرنے کی اجازت نہیں ملتی ہے جو تصویر پر بہت زیادہ جگہ استعمال کرتا ہے۔ یہاں زیر مطالعہ پہلا کیس الفا میتھیلفینٹانیل ہے۔ اس گروپ میں 3-methylfentanyl کی طرح ایک متبادل ہے جس کی پچھلی مثال میں اس سیریز میں پچھلی تصویر پر جانچ کی گئی تھی (Fentanyl Synthesis p4.png)، لیکن یہ فینیتھائل چین پر ہے جیسا کہ پائپریڈائن کی انگوٹھی پر لگایا گیا ہے۔ پھر ہم دو سٹیریو سینٹرز کو نشان زد کرتے ہیں، ایک C-4 کاربن پر بالکل اسی طرح جیسے خود فینٹینیل پر، اور دوسرا C-α (الفا کاربن) پر۔ ان سٹیریو سینٹرز کو تشبیہ دینے کے لیے ہم نے N-(1-hydroxyethyl)-4-hydroxypiperidine کا انتخاب کیا۔ جب ہم تمام ممکنہ سٹیریوائزمرز کو نکالتے ہیں، تو ہم دیکھتے ہیں کہ C-4 سٹیریو سنٹر انتہائی ناقابل تسخیر ہے، اسے ایک حقیقی سٹیریو سنٹر کے طور پر ختم کر دیتا ہے۔ اس سے صرف 2 R/S اسائنمنٹس رہ جاتے ہیں جو حقیقی α-methylfentanyl کے لیے C-α (الفا کاربن) پوزیشن پر سٹیریو سینٹر کی واقفیت کی پیروی کرتے ہیں۔ ان پر 7S اور 7R کا لیبل لگا ہوا ہے، جو پائپریڈائن ڈیریویٹیو میں سٹیریو سینٹر کا عکس ہے جسے ہم C-7 پوزیشن پر استعمال کرتے تھے۔ یہ دلچسپ بات ہے کہ C-4 سٹیریو سینٹر، جس میں فینٹینیل میں کوئی سرائیکی سرگرمی نہیں ہے (پہلی مثال)، اسے 3-methylfentanyl میں آن دی-رنگ اضافے کے ساتھ فعال کرتا ہے، اور اسے دوبارہ α-methylfentanyl میں کھو دیتا ہے۔ - انگوٹی کا اضافہ۔ دوسرا کیس جس کا یہاں مطالعہ کیا گیا وہ اومفینٹینیل ہے۔ Ohmfentanyl میں 3 ممکنہ سٹیریو سینٹرز ہیں، جو ایک اور پائپریڈائن ڈیریویٹیو کے ذریعہ بہترین قیاس کیا جاتا ہے: N-(1-hydroxyethyl)-3-methyl-4-hydroxypiperidine۔ یہ ohmfentanyl میں تین ممکنہ سٹیریو سینٹرز، یعنی 4-C، 3-C، اور β-C (بیٹا کاربن) کو یکساں بنانے کے لیے ایک جیسی ساخت کا استعمال کرتا ہے۔ یہ تین سٹیریو سینٹرز بالترتیب C-4، C-3، اور C-7 میں یکساں ہیں۔ جب ہم تمام ممکنہ سٹیریوائزمرز کو نکالتے ہیں تو ہم دیکھتے ہیں کہ وہ جوڑی کے کسی بھی مجموعہ میں انتہائی ناممکن نہیں ہیں، اور اس وجہ سے ہمارے پاس 8 منفرد سٹیریوائیسومر اور 3 حقیقی سٹیریو سینٹرز ہیں۔ اس سے 8 منفرد R/S تفویض کے مجموعے حاصل ہوتے ہیں جن کا خاکہ یکساں مالیکیول کے سٹیریوائزمرز کے تحت عنوانات کے طور پر دیا گیا ہے۔हिन्दी: इस कंकाल आरेख में फेंटेनाइल और इसके एनालॉग्स के संश्लेषण को चित्रित किया गया है। इस आरेख में शामिल संशोधनों का संबंध स्टीरियोकेमिस्ट्री से है और फेंटेनाइल के जटिल एनालॉग्स के लिए अद्वितीय काह्न-इंगोल्ड-प्रीलॉग आर/एस असाइनमेंट का असाइनमेंट है।
Fentanyl analgoues की स्टीरियोकेमिस्ट्री पहले काउंटर-सहज ज्ञान युक्त लग सकती है, क्योंकि तर्क की जटिल और अनूठी प्रकृति के कारण कार्बनिक रसायनज्ञों को जटिल त्रि-आयामी ज्यामिति को आंतरिक बनाने के लिए विकसित करना चाहिए जैसे कि स्टीरियोकेमिस्ट्री को समझने के लिए आवश्यक। शुक्र है कि ये छवियां फेंटेनाइल के संभावित एनालॉग को अद्वितीय स्टीरियोइसोमर्स की कुल संख्या, अणु पर सच्चे स्टीरियोसेंटर की संख्या और उस एनालॉग के लिए उपयुक्त काहन-इंगोल्ड-प्रीलॉग आर / एस असाइनमेंट की संख्या में व्यवस्थित करने के लिए एक सरल प्रक्रिया का पालन करती हैं। . छवियों की इन श्रृंखलाओं में स्टीरियोकेमिस्ट्री के विश्लेषण में प्रयुक्त प्रक्रिया निम्नलिखित है: 1. सबसे पहले प्रतिबिम्ब तैयार किया जाता है। 2. दूसरा तारक संभावित स्टीरियोसेंटर द्वारा संकेतक (*) के रूप में रखा जाता है। 3. तीसरा प्रत्येक स्टीरियोसेंटर आर और एस ओरिएंटेशन के जोड़े स्टीरियोसेंटर के सभी संभावित क्रमपरिवर्तन के माध्यम से संयुक्त होते हैं। 4. चौथा क्रमपरिवर्तन सुपर-असंभवता के लिए जाँचा जाता है, यह दर्शाता है कि वे एक सच्चे स्टीरियोसेंटर के आसपास भिन्न हो रहे हैं और इसलिए क्रमपरिवर्तन वास्तव में स्व-समान स्टीरियोइसोमर हैं। इस प्रक्रिया का उपयोग वैध स्टीरियोइसोमर्स की संख्या का आकलन करते समय किया जाएगा, जिसमें फेंटेनाइल के एक एनालॉग की भविष्यवाणी की जाएगी। क्योंकि फेंटेनाइल के एनालॉग्स इतने बड़े हैं, और अणु के मोइइटी (उप-क्षेत्र) जो इसकी चिरलिटी के लिए प्रासंगिक हैं, इतने छोटे हैं, कि हम अक्सर फेंटेनाइल एनालॉग को एक ही संख्या के साथ एक छोटे, सरल अणु के रूप में पुन: पेश करते हैं, और इसके स्टीरियोसेंटर के बीच की गतिशीलता। यह महत्वपूर्ण स्थान बचाता है जिससे हमें अनावश्यक सामग्री को पुन: उत्पन्न नहीं करने की अनुमति मिलती है जो छवि पर बहुत अधिक स्थान लेती है। यहां अध्ययन किया गया पहला मामला अल्फा-मेथिलफेंटानियल है। इस समूह में 3-मेथिलफेंटानिल के समान एक प्रतिस्थापन होता है जिसे पिछले उदाहरण में इस श्रृंखला (फेंटेनल सिंथेसिस p4.png) में पिछली छवि पर जांचा गया था, लेकिन यह फेनिथिल श्रृंखला पर है जैसा कि पाइपरिडीन रिंग पर प्रत्यारोपित किया जा रहा है। फिर हम दो स्टीरियोसेंटर को चिह्नित करते हैं, एक C-4 कार्बन पर ठीक उसी तरह जैसे कि fentanyl पर होता है, और दूसरा C-α (अल्फा कार्बन) पर। इन स्टीरियोसेंटरों को अनुरूप बनाने के लिए हमने N-(1-हाइड्रॉक्सीएथिल)-4-हाइड्रॉक्सीपाइपरिडाइन को चुना। जब हम सभी संभावित स्टीरियोइसोमर्स निकालते हैं, तो हम देखते हैं कि सी -4 स्टीरियोसेंटर सुपर-इम्पोज़ेबल है, इसे एक सच्चे स्टीरियोसेंटर के रूप में समाप्त कर देता है। यह केवल 2 आर/एस असाइनमेंट छोड़ता है जो वास्तविक α-मेथिलफेंटानिल के लिए सी-α (अल्फा कार्बन) स्थिति पर स्टीरियोसेंटर के उन्मुखीकरण का पालन करता है। इन्हें 7S और 7R लेबल किया गया है, जो पाइपरिडीन व्युत्पन्न में स्टीरियोसेंटर का प्रतिबिंब है जिसका उपयोग हम C-7 स्थिति में करते थे। यह दिलचस्प है कि सी -4 स्टीरियोसेंटर, जिसमें फेंटेनाइल (पहला उदाहरण) में कोई चिरल गतिविधि नहीं है, इसे 3-मिथाइलफेंटनियल में ऑन-द-रिंग जोड़ के साथ सक्रिय करता है, और इसे फिर से α-मिथाइलफेंटानिल में एक ऑफ-द के साथ खो देता है। -रिंग जोड़। यहां अध्ययन किया गया दूसरा मामला ओमफेंटेनल है। ओमफेंटेनल में 3 संभावित स्टीरियोसेंटर होते हैं, जो एक अन्य पाइपरिडीन व्युत्पन्न द्वारा सर्वोत्तम रूप से अनुरूप होते हैं: एन- (1-हाइड्रॉक्सीएथाइल) -3-मिथाइल-4-हाइड्रॉक्सीपाइपरिडाइन। यह ओमफेंटेनल, अर्थात् 4-सी, 3-सी, और β-सी (बीटा कार्बन) में तीन संभावित स्टीरियोसेंटर को एनालॉग करने के लिए एक समान संरचना का उपयोग करता है। ये तीन स्टीरियोसेंटर क्रमशः सी -4, सी -3 और सी -7 में अनुरूप हैं। जब हम सभी संभावित स्टीरियोइसोमर्स को बाहर निकालते हैं तो हम देखते हैं कि वे जोड़ी के किसी भी संयोजन में सुपर-इम्पोज़ेबल नहीं हैं, और इसलिए हमारे पास 8 अद्वितीय स्टीरियोइसोमर्स और 3 सच्चे स्टीरियोसेंटर हैं। यह 8 अद्वितीय आर/एस असाइनमेंट संयोजन उत्पन्न करता है जो समान अणु के स्टीरियोइसोमर्स के तहत कैप्शन के रूप में उल्लिखित हैं।中文:该骨架图说明了芬太尼及其类似物的合成。此图中涵盖的修改与立体化学以及将独特的 Cahn-Ingold-Prelog R/S 分配分配给复杂的芬太尼类似物有关。
芬太尼类似物的立体化学乍一看似乎是违反直觉的,因为有机化学家必须发展复杂和独特的推理性质,以内化复杂的三维几何形状,例如理解立体化学所需的几何形状。值得庆幸的是,这些图像遵循一个简单的程序,将潜在的芬太尼类似物组织成独特立体异构体的总数、分子上真实立体中心的数量以及适合该类似物的 Cahn-Ingold-Prelog R/S 分配的数量. 在这一系列图像中用于立体化学分析的程序如下: 1.首先画出图像。 2. 第二个星号由潜在的立体中心放置作为指示符 (*)。 3.第三,通过立体中心的所有可能排列组合每个立体中心R和S方向的对。 4. 第四,检查排列的超级不可能性,表明它们围绕不是真正的立体中心而变化,因此排列确实是相同的立体异构体。 在评估预计芬太尼类似物将具有的有效立体异构体的数量时,将使用此程序。因为芬太尼的类似物非常大,而与其手性相关的分子部分(子区域)非常小,所以我们经常将芬太尼类似物复制为具有相同数量的更小、更简单的分子,并且其立体中心之间的动力学。这节省了大量空间,使我们不会复制占用大量图像空间的冗余材料。 这里研究的第一个案例是α-甲基芬太尼。该组包含类似于在本系列上一张图片(芬太尼合成 p4.png)的上一个示例中检查的 3-甲基芬太尼的取代,但它位于苯乙基链上,与植入哌啶环相对。然后我们标记两个立体中心,一个在 C-4 碳上,就像在芬太尼本身上一样,另一个在 C-α(α 碳)上。为了类比这些立体中心,我们选择了 N-(1-羟乙基)-4-羟基哌啶。当我们抽出所有潜在的立体异构体时,我们看到 C-4 立体中心是超级强加的,消除了它作为真正的立体中心。对于真正的 α-甲基芬太尼,这仅留下 2 个 R/S 分配遵循立体中心在 C-α(α 碳)位置的方向。这些被标记为 7S 和 7R,反映了我们使用的哌啶衍生物中位于 C-7 位置的立体中心。有趣的是,在芬太尼中没有手性活性的 C-4 立体中心(第一个例子)在 3-甲基芬太尼中通过环上加成将其激活,并在 α-甲基芬太尼中再次失去它并在-环加法。 这里研究的第二个案例是欧姆芬太尼。 Ohmfentanyl 有 3 个潜在的立体中心,最好用另一种哌啶衍生物类比:N-(1-羟乙基)-3-甲基-4-羟基哌啶。这使用类似的结构来类比欧姆芬太尼中的三个潜在立体中心,即 4-C、3-C 和 β-C(β 碳)。这三个立体中心分别在 C-4、C-3 和 C-7 中进行了类比。当我们画出所有潜在的立体异构体时,我们看到它们在任何配对组合中都不是超级强加的,因此我们有 8 个独特的立体异构体和 3 个真正的立体中心。这产生了 8 个独特的 R/S 分配组合,这些组合在类似分子的立体异构体下被概述为标题。日本語: フェンタニルとその類似体の合成は、この骨格図に示されています。この図でカバーされている変更は、立体化学と、フェンタニルの複雑な類似体へのユニークな Cahn-Ingold-Prelog R/S 割り当ての割り当てに関係しています。
フェンタニル類似体の立体化学は、有機化学者が立体化学を理解するために必要な複雑な三次元形状を内部化するために開発しなければならない複雑で独特な性質のため、最初は直観に反するように見えるかもしれません。ありがたいことに、これらの画像は、フェンタニルの潜在的な類似体を一意の立体異性体の総数、分子上の真の立体中心の数、およびその類似体に適した Cahn-Ingold-Prelog R/S 割り当ての数に整理するための簡単な手順に従います。 . これらの一連の画像の立体化学の分析に使用される手順は次のとおりです。 1.まず画像を描きます。 2. 2 番目のアスタリスクは、潜在的な立体中心によって指標として配置されます (*)。 3. 第 3 に、各立体中心 R および S 方向のペアが、立体中心のすべての可能な順列を介して結合されます。 4. 第 4 に、順列が超インポザビリティについてチェックされます。これは、順列が真の立体中心ではないものの周りで変化していることを示します。したがって、順列は真に自己同一の立体異性体です。 この手順は、フェンタニルの類似体が持つと予測される有効な立体異性体の数を評価するときに使用されます。フェンタニルの類似体は非常に大きく、そのキラリティーに関連する分子の部分 (サブ領域) は非常に小さいため、フェンタニル類似体を同じ数のより小さく単純な分子として再現することがよくあります。そのステレオセンター間のダイナミクス。これにより、スペースを大幅に節約できるため、画像上で多くのスペースを消費する冗長な素材を再現する必要がなくなります。 ここで研究された最初のケースは、α-メチルフェンタニルです。このグループには、このシリーズの前の画像 (Fentanyl Synthesis p4.png) の前の例で調べた 3-メチルフェンタニルと同様の置換が含まれていますが、ピペリジン環に埋め込まれているのではなく、フェネチル鎖にあります。次に、2 つの立体中心をマークします。1 つはフェンタニル自体と同じように C-4 炭素上にあり、もう 1 つは C-α (アルファ炭素) にあります。これらの立体中心を類推するために、N-(1-ヒドロキシエチル)-4-ヒドロキシピペリジンを選択しました。潜在的な立体異性体をすべて引き出すと、C-4 立体中心が超インポーズ可能であり、真の立体中心として排除されることがわかります。これにより、実際の α-メチルフェンタニルの C-α (アルファ炭素) 位置での立体中心の向きに従う 2 つの R/S 割り当てのみが残ります。これらは 7S および 7R とラベル付けされており、使用したピペリジン誘導体の立体中心が C-7 位置にあることを反映しています。興味深いのは、フェンタニルではキラル活性を持たない C-4 立体中心 (最初の例) が、3-メチルフェンタニルではオンザリング付加で活性化し、α-メチルフェンタニルではオフザリング付加で再びそれを失うことです。・リング追加。 ここで研究された 2 番目のケースは、オームフェンタニルです。 Ohmfentanyl には 3 つの潜在的な立体中心があり、別のピペリジン誘導体である N-(1-ヒドロキシエチル)-3-メチル-4-ヒドロキシピペリジンと最も類似しています。これは、同様の構造を使用して、オームフェンタニルの 3 つの潜在的な立体中心、すなわち 4-C、3-C、および β-C (ベータ炭素) を類推します。これらの 3 つの立体中心は、それぞれ C-4、C-3、および C-7 で類似しています。すべての潜在的な立体異性体を引き出すと、それらはペアリングのどの組み合わせでも重ね合わせることができないことがわかります。したがって、8 つの固有の立体異性体と 3 つの真の立体中心があります。これにより、類似分子の立体異性体の下にキャプションとして概説されている 8 つの固有の R/S 割り当ての組み合わせが得られます。 |
| Date | |
| Source | Own work |
| Author | Mplanine |
Licensing
- You are free:
- to share – to copy, distribute and transmit the work
- to remix – to adapt the work
- Under the following conditions:
- attribution – You must give appropriate credit, provide a link to the license, and indicate if changes were made. You may do so in any reasonable manner, but not in any way that suggests the licensor endorses you or your use.
- share alike – If you remix, transform, or build upon the material, you must distribute your contributions under the same or compatible license as the original.
Captions
Items portrayed in this file
depicts
14 August 2022
image/png
File history
Click on a date/time to view the file as it appeared at that time.
| Date/Time | Thumbnail | Dimensions | User | Comment | |
|---|---|---|---|---|---|
| current | 23:57, 15 August 2022 |  | 1,900 × 2,500 (302 KB) | Mplanine | Uploaded own work with UploadWizard |
File usage
The following page uses this file:
Metadata
This file contains additional information, probably added from the digital camera or scanner used to create or digitize it.
If the file has been modified from its original state, some details may not fully reflect the modified file.
| Horizontal resolution | 78.74 dpc |
|---|---|
| Vertical resolution | 78.74 dpc |
| File change date and time | 04:43, 15 August 2022 |
